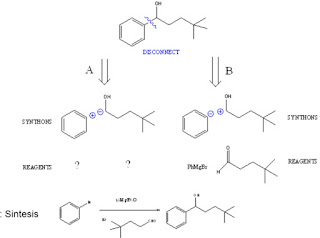
Pada blog saya sebelumnya saya sudah banyak sekali membahas mengenai materi kimia organik ini, dan pada kali ini saya akan membahas kembali materi kimia organik yaitu mengenai kekuatan asam dan basa dalam kimia organik. Dimana pada materi sebelumnya itu saya membahas mengenai prinsip - prinsip dalam sintesis senyawa organik khusunya flavon diretrosintesisnya. Pada blog kali ini saya akan lebih menjelaskan mengenai asam dan basa itu sendiri baru ke kekuatannya.
Asam merupakan senyawa kimia yang bisa dilarutkan didalam air dan akan menghasilkan larutan dengan pH lebih kecil dari 7 atau asam adalah senyawa yang dapat menyebabkan rasa masam pada berbagai materi. Contohnya seperti jeruk nipis, lemon, dan tomat. Basa merupakan senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air dengan pH nya diatas 7 atau basa adalah senyawa yang dapat bereaksi dengan asam menghasilkan senyawa yang disebut dengan garam. Contoh basa ini adalah sabun, sampo, pasta gigi dan lainnya.
1. Pengertian asam dan basa menurut para ahli
a. Arrhenius
- Asam merupakan senyawa yang jika dilarutkan dalam air melepaskan ion hidrogen H+.
- Basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion hidroksida OH−.
Asam merupakan senyawa kimia yang bisa dilarutkan didalam air dan akan menghasilkan larutan dengan pH lebih kecil dari 7 atau asam adalah senyawa yang dapat menyebabkan rasa masam pada berbagai materi. Contohnya seperti jeruk nipis, lemon, dan tomat. Basa merupakan senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air dengan pH nya diatas 7 atau basa adalah senyawa yang dapat bereaksi dengan asam menghasilkan senyawa yang disebut dengan garam. Contoh basa ini adalah sabun, sampo, pasta gigi dan lainnya.
1. Pengertian asam dan basa menurut para ahli
a. Arrhenius
- Asam merupakan senyawa yang jika dilarutkan dalam air melepaskan ion hidrogen H+.
- Basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion hidroksida OH−.
b. Bronsted Lowry
- Asam adalah pendonor proton hidrogen (H+).
- Basa adalah akseptor proton hidrogen (H+).
c. Boyle
- Asam adalah zat yang dapat memerahkan lakmus biru.
- Basa adalah zat yang dapat membirukan lakmus merah.
d. Lewis
- Asam adalah akseptor elektron
- Basa adalah donor elektron
2. Sifat dari asam dan basa
a. Sifat asam
Permasalahan :
1. Dapat dilihat pada tabel diatas terdapat contoh asam kuat yaitu ada HCl dan HSO4-, Mengapa letak dari HCl itu lebih tinggi jika dilihat didalam tabel, apa yang menyebabkan hal itu dapat terjadi dibandingkan dengan HSO4-?
2. Pada gambar diatas terdapat asam klorat dan asam perklorat, bagaimanakah cara membedakan asam tersebut sedangkan mereka sama - sama dari asam kuat?
3. Dari reaksi diatas, manakah basa yang lebih kuat, jika dilarutkan didalam air, dan mengapa demikian?
- Asam adalah pendonor proton hidrogen (H+).
- Basa adalah akseptor proton hidrogen (H+).
c. Boyle
- Asam adalah zat yang dapat memerahkan lakmus biru.
- Basa adalah zat yang dapat membirukan lakmus merah.
d. Lewis
- Asam adalah akseptor elektron
- Basa adalah donor elektron
2. Sifat dari asam dan basa
a. Sifat asam
- Mempunyai rasa asam dan bersifat korosif
- Dapat mengubah warna kertas lakmus biru menjadi warna merah
- Dapat menghantarkan arus listrik untuk asam kuat
- Bereaksi dengan logam untuk asam kuat.
- Dapat menetralkan asam
- Menghantarkan arus listrik
- Dapat mengubah kertas lakmur merah menjadi kertas lakmus biru
- Mempunyai rasa pahit dan merusak kulit,
- Terasa licin seperti sabun jika terkena kulit
3. Kekuatan asam dan basa
Kekuatan asam biasanya dipengaruhi oleh banyaknya ion - ion H+ yang dihasilkan oleh senyawa asam dalam larutannya. Berdasarkan banyak sedikitnya ion H+ yang dihasilkan, larutan asam dapat dibedakan menjadi dua yaitu :
a. Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya menjadi ion - ionnya. Asam kuat merupakan zat yang didalam pelarut air mengalami ionisasi sempurna. Contoh asam kuat yaitu HCl, HNO3, dan H2SO4.
b. Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit terionisasi menjadi ion - ionnya. Contoh asam lemah yaitu H2O, NH3, dan HCN.
Kekuatan basa dipengaruhi oleh banyaknya ion - ion OH- yang dihasilkan oleh senyawa basa dalam larutannya. Berdasarkan banyak sedikitnya ion OH- yang dihasilkan, larutan basa dapat dibedakan menjadi dua yaitu :
a. Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion - ionnya. Basa kuat merupakan zat yang didalam air terionisasi sempurna. Contoh basa kuat yaitu NaOH, KOH, dan Ca(OH)2.
b. Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion - ionnya. Contoh dari basa lemah adalah Cl-, NO3-, dan ClO4-.
Penggunaan bahan kimia sebagai bahan tambahan pada makanan (food additive) saat ini sering ditemui pada makanan dan minuman. Salah satu bahan tambahan pada makanan adalah pengawet bahan kimia yang berfungsi untuk memperlambat kerusakan makanan, baik yang disebabkan mikroba pembusuk, bakteri, ragi maupun jamur dengan cara menghambat, mencegah, menghentikan proses pembusukan dan fermentasi dari bahan makanan.
Salah satu bahan pengawet yang banyak digunakan adalah asam benzoat. Asam benzoat lebih banyak digunakan dalam bentuk garamnya karena kelarutannya lebih baik daripada bentuk asamnya. Bentuk garam dari asam benzoat yang banyak digunakan adalah natrium benzoat. Benzoat dan turunannya dapat menghancurkan sel-sel mikroba. Natrium benzoat bekerja efektif pada pH 2,5-4 sehingga banyak digunakan pada makanan atau minuman yang bersifat asam. Benzoat sering digunakan untuk mengawetkan berbagai pangan dan minuman seperti sari buah minuman ringan, saus tomat, saus sambal, selai, jeli, manisan, kecap dan lain-lain.
Asam benzoat/ asam benzene karboksilat/ asam phenil karboksilat (C7H6O2 atau C6H5COOH) merupakan suatu senyawa kimia yang umum digunakan sebagai bahan pengawet yang dianggap GRAS oleh FDA, dan secara kimia dapat dihasilkan melalui oksidasi fase cair dari toluena. Asam benzoat memiliki bentuk serbuk kristal padat, tidak berwarna, tidak berbau, sedikit terlarut didalam air, tetapi larut dalam etanol dan sangat mudah larut dalam benzena dan aseton. Asam benzoat, dalam bahan pangan umum digunakan sebagai bahan pengawet. Namun diluar itu, juga dapat dimanfaatkan sebagai penghambat korosi.
Permasalahan :
1. Dapat dilihat pada tabel diatas terdapat contoh asam kuat yaitu ada HCl dan HSO4-, Mengapa letak dari HCl itu lebih tinggi jika dilihat didalam tabel, apa yang menyebabkan hal itu dapat terjadi dibandingkan dengan HSO4-?
2. Pada gambar diatas terdapat asam klorat dan asam perklorat, bagaimanakah cara membedakan asam tersebut sedangkan mereka sama - sama dari asam kuat?
3. Dari reaksi diatas, manakah basa yang lebih kuat, jika dilarutkan didalam air, dan mengapa demikian?